Sodobne raziskave v biokemiji in molekularni biologiji, pa tudi drugih vedah o življenju, so usmerjene predvsem v ugotavljanje molekularnih mehanizmov življenja. Tema je za strokovnjake na teh področjih zanimiva podobno, kot je v fiziki proučevanje osnovnih delcev.
V vsakdanjem življenju pa se ta odkritja pogosto uporabijo za izboljšanje kakovosti življenja, na primer za razvoj novih načinov zdravljenja bolezni. V zadnjem času se tako razvija tako imenovana personalizirana medicina, ki veliko uporablja prav izsledke biokemije in molekularne biologije.
Razvoj visokozmogljivih tehnologij, ki omogočajo hitro in enostavno pregledovanje velikih količin informacij, je na področju ved o življenju v zadnjih desetletjih pripeljal do vrhunskih preskokov pri razumevanju življenja. Eden od teh mejnikov je bila določitev zaporedja človeškega genoma pred desetimi leti. Izkazalo se je, da je poznavanje dedne zasnove tako kompleksnega organizma, kot je človek, le majhen prvi korak na poti do razumevanja njegovega delovanja. Zapis življenja, ki je shranjen v genomu, se mora namreč prepisati v prenašalne molekule RNK, ki se prevedejo v beljakovinske molekule, te pa nato na različne načine posredujejo informacijo v gradnjo in delovanje celic ter celotnega organizma. Pri njihovem delovanju je zelo pomembna tudi nadgradnja v obliki različnih sprememb in dodatkov, kot so fosforilacija, glikozilacija, skrajšanje v obliko z drugačnimi funkcionalnimi lastnostmi ali povezovanje z različnimi drugimi molekulami. Izkazalo se je namreč, da je na vsakem delu poti, od hranjenja informacij v genskem zapisu na ravni DNK do prenosa informacije prek RNK in beljakovin ter drugih molekul, veliko stranpoti, bližnjic, krožnih poti in labirintov.
Kot pogled iz letala
Naslednji korak k razumevanju delovanja organizma torej vodi prek delovanja posameznih molekul, ki gradijo, sestavljajo, se zadržujejo oziroma potujejo po tej kompleksni molekularni pokrajini. Visokozmogljive tehnologije pregledovanja celostne slike te pokrajine si lahko predstavljamo kot slikanje naravne pokrajine iz letala. Celosten pogled od daleč nam omogoča primerjavo med, na primer, kmetijsko obdelanim območjem in puščavo, v jeziku ved o življenju pa med zdravim in bolezenskim stanjem organizma, tkiva ali celice. Celostno tako lahko preiskujemo in primerjamo nivo genskega zapisa (genomika), zapisa prenašalnih molekul (transkriptomika) in različne nivoje beljakovin (proteomika) in drugih molekul (metabolomika, lipidomika, glikomika itn.). Konkretno lahko primerjamo, kateri geni in molekule (DNK, RNK, beljakovine, lipidi, sladkorji …) se v bolezenskem stanju obnašajo drugače kot v zdravem, saj so molekule, pri katerih opazimo spremembe v lastnostih ali količini, verjetno vpletene v razvoj bolezni. In ravno te molekule se izberejo za predmet podrobnejših raziskav.
Zaradi kompleksnosti organizmov običajno ne opazimo le nekaj sprememb, ampak zelo obsežno, včasih neobvladljivo število spremenjenih molekul, ki so med seboj soodvisne. Za razvoj bolezni je namreč na molekularni ravni odgovoren kompleksen preplet dejavnikov, saj različne lastnosti molekul v različnih pogojih in njihovo sodelovanje z drugimi molekulami lahko pripeljejo od zdravega do bolezenskega stanja. Podobno kot razkroj kmetijsko obdelane pokrajine v puščavo povzroči več dejavnikov, od posamičnih odločitev ljudi v lokalni in širši skupnosti do delovanja različnih naravnih dejavnikov. Da bi razumeli, kako je proces potekal, seveda z namenom, da bi v prihodnje lahko nanj vplivali, se moramo tako lotiti podrobnega pregleda posameznih dejavnikov (molekul), njihovega delovanja (mehanizmov) in njihovih interakcij (mrež). To dopolnjuje celostni pristop in predstavlja drug vidik pristopa k raziskavam na področju ved o življenju, to je analizo posameznih molekul in molekularnih mehanizmov. Kljub večplastnosti odprtih vprašanj ob proučevanju ugotovimo, da so si molekularni mehanizmi pri različnih organizmih podobni, zato nam pri razumevanju molekularne pokrajine enega organizma pomagajo izsledki pri drugih. Tako je bilo na primer veliko molekularnih mehanizmov različnih celičnih procesov najprej opisanih pri rastlinah ali mikroorganizmih, to znanje pa se je potem preneslo na razumevanje procesov pri ljudeh in živalih.
Škodljivo kopičenje beljakovin
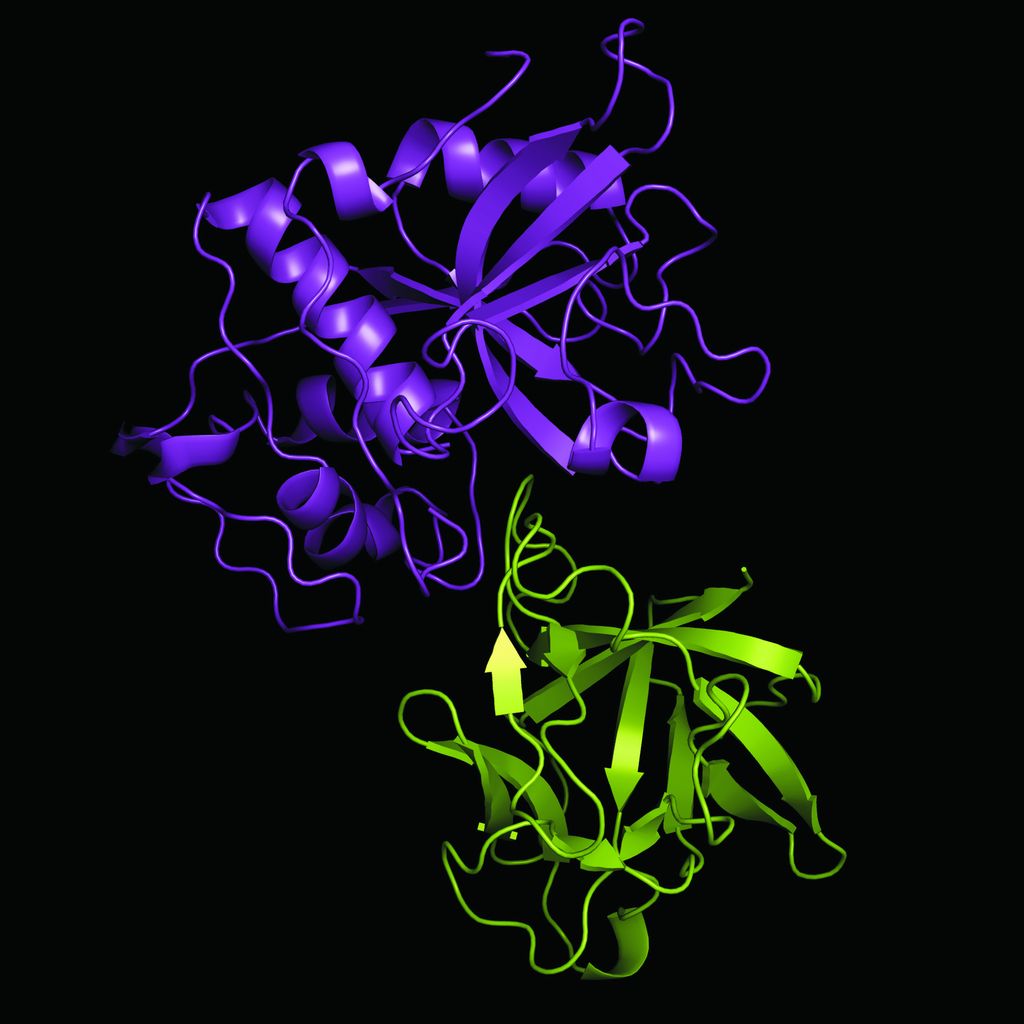
Za nevrodegenerativne bolezni, kot so alzheimerjeva in parkinsonova bolezen, frontotemporalna demenca (FTD) in amiotrofična lateralna skleroza (ALS) ter prionske bolezni, ugotavljamo, da prihaja do kopičenja določenih beljakovin v živčnih celicah ali njihovi bližini, kar vodi v celično smrt oziroma njihovo »nepravilno« delovanje. Pri različnih nevrodegenerativnih boleznih se kopičijo različne beljakovine kot posledica različnih dejavnikov in tudi posamezna nevrodegenerativna bolezen je lahko posledica kopičenja različnih beljakovin oziroma kombinacije beljakovin pri različnih posameznikih. Pri alzheimerjevi bolezni se tako kopičita amiloid-beta v značilnih amiloidnih plakih ter beljakovina tau v živčnih celicah, pri parkinsonovi se kopiči beljakovina alfa-sinuklein, medtem ko se pri FTD-ju in ALS-u najpogosteje kopiči pred kratkim odkrita beljakovina TDP-43. Zadnja leta se intenzivno razvijajo metode, ki bi z določanjem prisotnosti teh in drugih molekul (predvsem v plazmi in cerebrospinalni tekočini) omogočile zgodnje odkrivanje in rutinsko diagnostiko različnih tipov nevrodegenerativnih bolezni. Razumevanje vzrokov za kopičenje teh beljakovin, torej molekularnih mehanizmov nastanka teh bolezni, je ključen korak pri razvoju novih načinov zdravljenja, ki ne bodo zgolj simptomatski.
Poznavanje posameznih molekul, vpletenih v nastanek bolezni, torej omogoči njihovo uporabo kot diagnostičnih označevalcev, ki omogočajo zgodnejše odkrivanje bolezni, njihovo uporabo kot tarč za različne terapevtske pristope ali njihovo uporabo kot prognostičnih označevalcev, ki olajšajo napovedovanje napredovanja bolezni in usmerjajo postopke zdravljenja. Poznavanje in uporaba takih molekulskih označevalcev pri načrtovanju zdravljenja omogočata tako imenovano personalizirano medicino, to je zdravljenje, prikrojeno posamezniku. Glede na molekulske označevalce pri posamezniku lahko na podlagi specifičnega mehanizma razvoja bolezni izberemo zdravljenje, ki bo učinkovito oziroma bo povzročilo manj stranskih učinkov.
Različni molekulski profili
Največ primerov personaliziranega zdravljenja, ki se že uporabljajo v praksi, najdemo pri zdravljenju različnih vrst rakavih obolenj. Zanje je podobno kot za nevrodegenerativne bolezni značilno, da se razvijejo po različnih molekularnih mehanizmih pri različnih posameznikih. Odkrivanje molekularnih mehanizmov razvoja bolezni, h kateremu pomembno prispevamo tudi slovenski raziskovalci, bo v prihodnosti omogočilo usmerjene pristope k preprečevanju, diagnozi in zdravljenju različnih bolezni glede na specifične molekulske profile posameznikov.
Dr. Jerica Sabotič Odsek za biotehnologijo, Institut Jožef Stefan, Ljubljana
 Tiskane izdaje
Tiskane izdaje