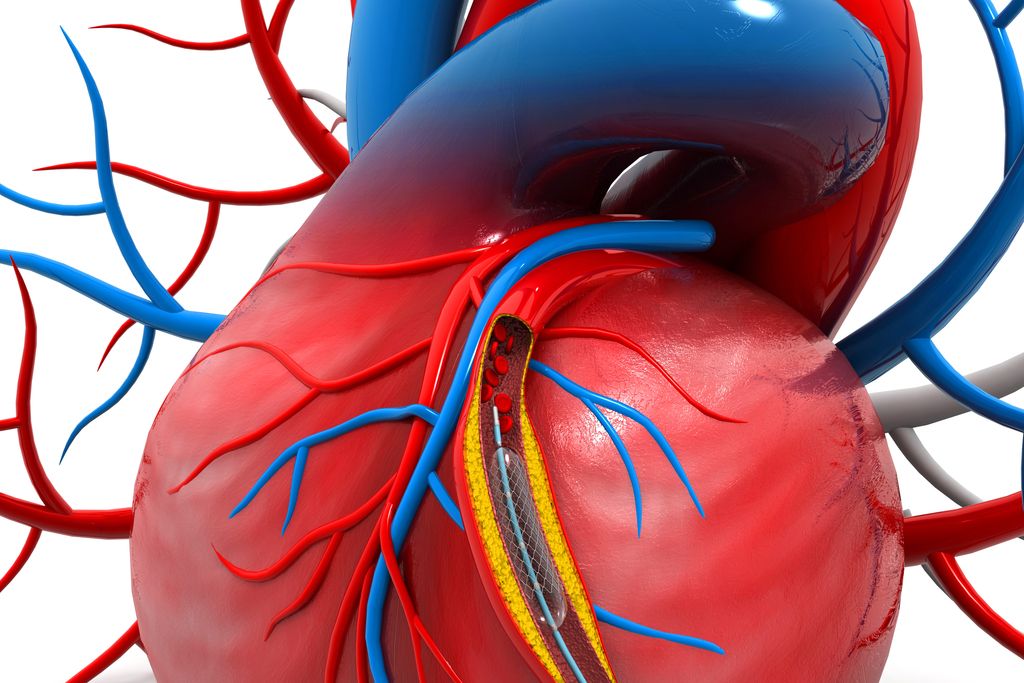
Zaradi velike razširjenosti okvar srčne mišice in velike smrtnosti, povezane z boleznimi srca in ožilja, že vrsto let potekajo prizadevanja za izboljšanje modela srčne mišice in vitro, s tako imenovanim laboratorijem na čipu. Ti modeli še niso uporabni kot nadomestki za presaditev, so pa zelo primerni za raziskave, ki bodo vodile k boljšemu razumevanju bolezenske fiziologije srčnih okvar ter razvoju zdravil zanje in za ugotavljanje stranskih učinkov drugih zdravil, ki so toksična za srčno mišico.
»Na splošno je razvoj inovativnih večceličnih tridimenzionalnih (3D) modelov, tako imenovanih sferoidnih struktur, v velikem porastu za vse vrste tkiv, tako normalnih kot tumorskih. Še pred nedavnim smo učinke zdravil ali škodljivih snovi iz okolja na izbrane vrste živalskih ali človeških celic proučevali v in vitro dvodimenzionalnih (2D) kulturah. Te smo uporabljali tudi za določanje lastnosti tkiv na podlagi celičnega obnašanja v teh kulturah. Ko smo prešli na prostorske tehnike gojenja v 3D-modelih, pa smo ugotovili, da se v njih celice zelo drugače vedejo in komunicirajo v drugačnem biokemijskem jeziku,« komentira dogajanje na tem področju v povezavi z dosežkom kanadske skupine prof. dr. Tamara Lah Turnšek, direktorica nacionalnega inštituta za biologijo.
Na njihovem inštitutu se namreč prav tako ukvarjajo z raziskavami te vrste in pred kratkim so v znanstveni reviji Oncotarget objavili ugotovitve raziskovalne skupine, ki jo poleg Lahove sestavljajo Barbara Breznik, Helena Motain, Miloš Vittori in Ana Rotter, o tem, kako mezenhimske matične celice vplivajo na tumorske celice v naravnem okolju ribjih možganov.
Kot še pojasnjuje sogovornica, se večinoma, posebno ko gre za različne vrste celic, te »nasajajo« in vraščajo v ogrodje, ki narekuje zgradbo sferoida. Danes je tako razvitih veliko različnih sintetičnih in naravnih ogrodij, ki so sicer inertna ali celo biorazgradljiva in omogočajo boljše medcelične interakcije v sferoidih. Ti so tako postali predvidljivi, merljivi, želenih lastnosti in so veliko prispevali k znanju o delovanju tkiv, učinkih zdravil in onesnaževalcev okolja.
Vendar pa vse celice, gojene v teh sokulturah, začnejo kmalu izločati tudi svoje lastne oporne molekule. Te potem tvorijo njihovo naravno ogrodje. Umetno jim ni pogodu, saj delno moti sicer naravne poti komunikacije med celicami, kot te potekajo v živem tkivu.
Biokemijske vezi,
Slednje so v primerjavi s celicami zelo majhne, membranam podobne strukture lipidov, ki pa težijo k zlitju s celično površino, in ob tem se vmesniki z dvema komplementarnima kemijskima skupinama, ketonsko in oksiaminsko, kovaletno povežejo. S tem povežejo tudi membrani dveh različnih vrst celic prek ortogonalno vezanih molekul, ki naravno med seboj spajajo celice. Ta fuzija liposomov in celic, ki poteka po sistemu 'ViaGlu', je zanimiva inovacija nevtralne vezave med celicami, ki pa ne zmoti 'pogovornega jezika' celic,« razlaga sogovornica.
Kot še dodaja, z nadgrajevanjem celičnih modelov tako nastajajo prototipi tkiv kože, jeter, trebušne slinavke in drugih organov. V luči teh raziskav je celica srčne mišice še posebno zahtevna. Srce je namreč gosta masa srčnomišičnih celic, ki črpa kri skozi krožni sistem arterij in ven, posebej pomembno za naravno delovanje – bitje srca – pa je razmerje med vsemi celicami tkiva ter raznovrstnimi proteini, ki jih naravno povezujejo v tem sofisticiranem tridimenzionalnem modelu.
Organi in človek na čipu?
Mikroinženirski pristop danes znanstvenikom omogoča, da najprej razvijejo najbolj enostaven celični model, ki je še vedno fiziološko ustrezen, potem pa sistemu postopoma dodajajo kompleksnost, kar pri živalskem modelu ni mogoče. Znanstveniki si prizadevajo pripraviti širše uporaben model, »človeško telo na čipu«.
Kot pove že izraz, bi z njim ponazorili fiziologijo več vrst organov, in ne le to, več modelov organov na čipu bi povezali z mikrofluidnimi kanali, to pa bi omogočilo raziskovanje veliko vrst bolezenskih stanj in hitrejšo pot do zdravil. Veliko bolezni prizadene ves sistem, torej celoten organizem, celovit pa je tudi vpliv zdravil, kar se izraža v njihovih stranskih učinkih, ki bi jih s tem sistemom poskušali zmanjševati.
Take večorganske sisteme bi lahko pridobili iz vzorcev več različnih kliničnih podskupin bolnikov in preizkušali zdravila na teh sistemih namesto na bolnikih. S takšnimi kliničnimi testi in vitro bi hitreje, za bolnike prijazno in morda tudi ceneje ugotavljali učinkovitost zdravil in uspešnejše zdravljenje.
Pričakovanja in nejasnosti
»Kako rekonstruirati primerno mikrostrukturo v kompleksnem biokemijskem okolju ob hkratni dinamiki mehanskih sil, ki jih ustvarja medceličnina, na primer strižne sile, pa še vedno povzroča težave pri tem modelu. Težava pri živih modelih je v spremenjenih lastnostih celic in vitro, kar imenujemo tudi plastičnost celic. To še posebej velja za modele, ki vključujejo tudi matične celice, s čimer se srečujemo pri našem delu, kjer gojimo celo dvoje vrst – tumorske in mezenhimske matične celice v tridimenzionalnem okolju,« pojasnjuje Lah Turnškova in dodaja: »V želji po večji kompleksnosti sistema, da bi organ čim bolje ponazorili, pa se po drugi strani lahko zmanjšuje ponovljivost poskusov, kot jo opažamo v enostavnejših dvodimenzionalnih modelih. Cilj je torej izdelati čim bolj organu podoben sistem, a dovolj enostaven, da nam da relevantne odgovore o učinkovitosti zdravil, toksičnosti in drugem, kar bi se dogajalo v živem organizmu.«
Prepad med modeli
Danes so celični modeli vse bolj kompleksni v primerjavi s preteklimi enostavnimi poskusi na celicah v monokulturah in vse bolj nepogrešljivi.
»Predvsem zato, ker so nas poskusi na živalih, s katerimi smo v biomedicinskih raziskavah začeli že kmalu po poskusih na eni sami vrsti celic, pravzaprav razočarali,« pove Lahova. Neposreden prenos modela od ene celice do kompleksnosti živalskega organizma je namreč prevelik, da bi to kompleksnost lahko vedno razumeli.
»Tako zeva prepad med modeli in vitro in in vivo , ki pa ga v zadnjem času zapolnjujejo ti večcelični modeli, organi na čipu«, pojasnjuje prof. Tamara Lah Turnšek.
Pri tem poudarja, da so omenjene in številne druge raziskave, s katerimi se ukvarjajo tudi pri nas, predvsem v razvojni fazi drage. V njeni raziskovalni skupini razvijajo zlasti modele z multicentričnimi tumorskimi sferoidi, da bi čim bolje ponazorili rastočo in agresivno tumorsko maso prvotnega tumorja. To naj bi pomagalo najti čim bolj učinkovito zdravilo ali več zdravil, ki bi v kombinaciji lahko uničila tumorske celice in celice njihovega okolja. Pri tem so prav tridimenzionalni organoidni modeli najbolj primerni.
 Tiskane izdaje
Tiskane izdaje